| Obwohl zwei der Modifikationen des
Kohlenstoffs, nämlich Graphit und Diamant, seit langem bekannt sind, wurde die dritte
Modifikation, die Fullerene, erst gegen Ende des 20. Jahrhunderts vor wenigen Jahren
entdeckt. Diese Entdeckung war ein Resultat von Grundlagenforschung und
interdisziplinärer Kooperation zwischen Chemie und Physik auf dem Gebiet der Cluster [1].
Eine besondere Rolle spielten hierbei auch Vorstellungen von Astrophysikern über
interstellaren Staub [2]. Bei der Untersuchung von Kohlenstoffclustern in
Molekularstrahlen beobachteten Curl, Kroto, Smalley und Mitarbeiter geschlossene Käfige
aus Kohlenstoffatomen der Zusammensetzung Cn, wobei n eine ganze Zahl ist [1].
Hierfür erhielten sie 1996 den Nobelpreis für Chemie. Das herausragendste Molekül war
hierbei das C60-Fulleren, das fast die Gestalt einer Kugel besitzt und aus 60
Kohlenstoffatomen besteht.
Angeregt durch die Konstruktionen der Kuppelbauten des Architekten Buckminster Fuller, der
seine Kuppeln aus Sechsecken und Fünfecken zusammenzusetzen pflegt, gaben Kroto und
Mitarbeiter den neuentdeckten Kohlenstoffmolekülen den Namen Buckminsterfullerene, im
englischen Sprachgebrauch auch "Buckyballs" genannt. Heute hat sich der etwas
kürzere Name "Fullerene" durchgesetzt. Einige Jahre später fanden die
Astrophysiker Krätschmer, Huffman und Mitarbeiter einen Weg, diese Moleküle in großer
Menge zu produzieren [2]. Dabei war ihr Interesse gar nicht, C60 herzustellen,
sondern den interstellaren Staub und die Chemie eines Roten Riesen im Labor zu simulieren.
Mehr zufällig entdeckten sie im Ruß einer abgebrannten Lichtbogenelektrode einen großen
Anteil an C60 (etwa zehn Prozent) und C70 (etwa ein Prozent) sowie
höhere Fullerene (0,1 Prozent). Es muß davon ausgegangen werden, daß in jeder Art von
Ruß, sei es nun der einer Kerze, von Autoabgasen oder Fabrikschloten, Fullerene in mehr
oder weniger großer Zahl vorhanden sind, je nach Temperatur der Verbrennung.
Bereits um 1970 gab es Überlegungen von dem japanischen Chemiker Osawa [3], ob es nicht
ein Molekül wie C60 mit einer stabilen Kohlenstoffkonfiguration geben könnte,
und Theoretiker berechneten bereits wenig später die elektronische [4] und
gruppentheoretische [5] Struktur dieses Moleküls. Die 60 Kohlenstoffatome sind
hochsymmetrisch auf einer Kugeloberfläche angeordnet (Abb. 1 links), genaugenommen
handelt es sich um einen abgeflachten Ikosaeder, ein platonischer Körper mit höchster
Symmetrie. Alle anderen Fullerene weichen stärker von der Kugelform ab. Bereits Leonardo
da Vinci hat einen derartigen Körper gezeichnet (Abb. 2). Nicht zuletzt sollte jeder
Fußballbegeisterte im C60 die Form des klassischen Fußballs wiedererkennen.
1. Fullerenmoleküle - Kristalle, Zwiebeln und Röhren
Unmittelbar nach der Entdeckung der Massenproduktion von Fullerenen [2] mit Hilfe eines
einfachen Kohlelichtbogens und der anschließenden chemischen Extraktion der
Fullerenmoleküle aus dem Ruß setzte eine ungeheure Forschungsaktivität auf diesem
Gebiet mit einem exponentiellen Wachstum an wissenschaftlichen Publikationen ein.
Allgemeinverständliche Arbeiten zu dieser Thematik wurden in der Anfangszeit von den
Entdeckern in der Zeitschrift Science [6-8] veröffentlicht. Über aktuelle Forschungen
auf diesem Gebiet wurde in jährlich wachsender Zahl auf internationalen Tagungen und in
wissenschaftlichen Zeitschriften berichtet. Viele erste und aktuelle Ergebnisse sind in
den Tagungsbänden der vom Autor mit organisierten "International Winterschool on
Electronic Properties of Fullerenes" enthalten [9-11].
Die Grundstruktur der Fullerene besteht aus Fünfecken (Pentagons) und Sechsecken
(Hexagons). Es ist möglich, geschlossene Cn-Käfige mit exakt 12 Fünfecken
und (n/2-10) Sechsecken für alle geraden Werte von n >= 24 zu konstruieren. Die so
erhaltenen geschlossenen Kohlenstoffkäfige stellen die Fullerene dar. In Fullerenen
befindet sich an jedem Vertex ein Kohlenstoffatom, von dem aus drei Bindungen zu den
Nachbarkohlenstoffatomen gehen (Abb. 1). Auf diese Weise entstehen 3n/2-Bindungen und
n/2+2-Flächen. Die 12 Fünfecke stellen sicher, daß die Käfige geschlossen sind,
ansonsten gibt es offene Strukturen. Wenn keine weiteren Einschränkungen gemacht werden,
sind noch eine Vielzahl von Isomeren, das heißt verschiedenartige Fullerene Cn mit
gleichem n möglich. So gibt es für n gleich 24 und 26 zwar nur jeweils 1 Isomer, aber
für n = 28 bereits 2 Isomere und für n = 40 schon 50 Isomere. Die Zahl der Isomere
steigt steil an und würde für C60 genau 1812 verschiedene Isomere ergeben.
Dies wurde bisher so nicht gefunden und man geht deshalb von einer weiteren Einschränkung
aus, der Regel sogenannter "isolierter Fünfecke", das heißt es sind keine
aneinandergrenzenden Fünfecke erlaubt. Mit dieser Einschränkung gibt es nur ein C60
- und ein C70 -Isomer (Abb. 3), aber bereits neun Isomere des C82,
von denen nur eins in Abbildung 3 gezeigt ist. Die Zahl wächst auch hier rasch mit der
Zahl der Kohlenstoffatome und ergibt zum Beispiel für n = 100 genau 450 Isomere.
Dies zeigt die Vielfalt und die Fülle der möglichen Erscheinungsformen von Fullerenen.
Das wohl bekannteste und verbreitetste Fulleren C60 kristallisiert in einem
kubisch flächenzentrierten Gitter (kfz), bei dem die Einheitszelle aus einem Würfel
besteht, auf dessen Ecken und Flächen sich je ein C60 -Molekül befindet. Bei
Zimmertemperatur rotieren die Moleküle stochastisch mit einer Sprungrate von etwa
1011-1012 s-1. Mit sinkender Temperatur wird die Sprungrate geringer, bis die Rotation bei
tiefen Temperaturen praktisch zum Stillstand kommt und eine geordnete Orientierung der
Moleküle entsteht. Höhere Fullerene kristallisieren ebenfalls, allerdings meistens in
einer niedrigeren Kristallsymmetrie.
Neben diesen kristallinen Fullerenen sind in den vergangenen Jahren komplexere Strukturen
von Fullerenen entdeckt worden. Zu diesen gehören die sogenannten Zwiebeln (Onions) (Abb.
4) [12, 13] und Röhren (Nanotubes) (Abb. 5) [14, 15, 16]. Die Namur-Forschergruppe hat
kürzlich auf die verschiedenen Möglichkeiten der Krümmungen derartiger Nanotubes
hingewiesen und eine Fülle verschiedener Formen wie Schlingen, Schlaufen und Spulen
gefunden (Abb. 6) [17].
2. Elektronische Zustände des C60-Fullerens
Die elektronischen Zustände der Hauptvertreter der Fullerene sind mit allen zur
Verfügung stehenden Methoden der Quantenmechanik berechnet worden. Diese reichen von
einfachen Hückel-Molekularorbital-(MO-)Rechnungen über semiempirische
Hartree-Fock-Methoden bis zu ab-initio-Methoden auf der Basis der Hartree-Fock-Näherung
und des Dichtefunktional-Ansatzes. Hier sollen zunächst einfache Betrachtungen für das C60-Fulleren
genügen. Nehmen wir an, daß drei der vier Valenzelektronen eines jeden C-Atoms in den
drei Bindungen zu dem jeweiligen Nachbarn "verbraucht" werden, so steht noch ein
Elektron (pz-Orbital) pro C-Atom zur freien Verfügung. Ein einfaches Modell
der elektronischen Struktur des C60 ergibt sich also aus der Hüpfbewegung
dieses Elektrons über alle 60 Positionen der C-Atome (Hückel-Modell).
Bevor wir auf dieses Modell näher eingehen, wollen wir eine noch einfachere Betrachtung
anstellen. Wir stellen uns die Frage: Wie sehen die elektronischen Zustände aus, wenn wir
60 Elektronen auf einer Kugel verteilen? Die zugehörigen Eigenfunktionen sind
offensichtlich die Kugelflächenfunktionen, die eine Quantisierung des Drehimpulses
darstellen. Die Energiezustände lassen sich entsprechend Abbildung 7 aufbauen, wobei zu
jeder Drehimpulsquantenzahl L = 0, 1, 2, 3, … genau 2L+1 entartete
(gleichenergetische) Zustände existieren, die entsprechend dem Pauli-Prinzip (maximal 2
Elektronen mit Spin auf und ab pro Zustand) besetzt werden, bis alle 60 Elektronen
"verbraucht" sind. Wie man sieht, sind von den am höchsten besetzten Zuständen
genau fünf besetzt. Dies wird uns bei der Anwendung der Hückel-Methode wieder begegnen.
Die höchstenergetischen Elektronen besitzen also bereits recht hohe Bahndrehimpulse.
Nun hat C60 nicht ganz die Form einer Kugel, sondern stellt, wie wir bereits
bemerkt haben, einen abgeflachten Ikosaeder dar. Diese etwas niedrigere Symmetrie bewirkt
eine teilweise Aufhebung der Entartung, so daß in der Hückel-Rechnung, in der die
Zustände entsprechend der Gruppensymmetrie klassifiziert sind, die fünf
höchstenergetischen Zustände (HOMO: highest occupied molecular orbital) mit hu-Symmetrie
voll besetzt sind und die drei niedrigsten unbesetzten Orbitale (LUMO: lowest unoccupied
molecular orbital) mit t1u-Symmetrie leer sind (Abb. 8) [18]. Es sollte an
dieser Stelle vermerkt werden, daß sich viele Eigenschaften des C60 mit diesem
einfachen Bild der elektronischen Struktur bereits erklären lassen.
Zunächst sei die optische Anregung von C60 kurz diskutiert. Bei Bestrahlung
des C60-Moleküls mit Licht werden Elektronen aus dem Grundzustand (besetzte
Zustände) in die leeren unbesetzten Zustände angehoben. Es entsteht also beispielsweise
ein "Elektronenloch" (Spin ½) in den besetzten Zuständen, während eins der
oberen leeren Zustände mit einem Elektron (Spin ½) besetzt wird. Nach Lichtanregung
befindet sich das C60-Molekül zunächst im angeregten Singulettzustand
(Gesamtspin S = 0, das heißt ¯ ), geht aber nach kurzer Zeit mit hoher Effizienz in
den Triplettzustand (Gesamtspin S = 1, das heißt ) über. Wegen der langen
Lebensdauer dieses Zustands (Konversionsverbot durch Spinerhaltung) wird die
Anregungsenergie in diesem Zustand gespeichert. Zeitaufgelöste
Elektronenspinresonanz-(ESR-)Signale zeigen eine ausgeprägte Feinstruktur und
Spinpolarisation sowie interessante dynamische Prozesse [19].
3. Endohedrale Fullerene
Da bei der Herstellung der Fullerene (Verbrennung von Kohlestäben) das Edelgas Helium
beigemischt wird, wurden bereits in den Anfängen der Fullerenproduktion einige C60-Moleküle
gefunden, die He eingeschlossen hatten. Später wurden auch andere Atome in C60
und weiteren Fullerenen eingeschlossen. Fullerene, die Atome im Inneren des Käfigs
enthalten, nennt man heute endohedrale Fullerene. Diese werden von den Physikern nicht
ganz der chemischen Konvention entsprechend mit M@Cn bezeichnet, wobei M ein
Atom außer Kohlenstoff darstellt und n>=60 ist. Abbildung 9 zeigt ein endohedrales C82-Molekül.
In unserem Institut werden zur Zeit N@C60, Y@C82 und La@C82
untersucht. Interessant bei den letztgenannten Molekülen ist die Tatsache, daß die
Metallatome Yttrium (Y) und Lanthan (La) jeweils drei Elektronen an das C82-Molekül
abgeben und selbst entsprechend dreifach positiv geladen sind.
Diese drei Elektronen bilden einen Gesamtspin S=½, der zu einem ESR-Signal führt, wie in
Abbildung 10 gezeigt ist. Hierbei zeigt sich deutlich die Kopplung des Y-Kernspins (I =
½) bzw. des La-Kernspins (I = 7/2), wobei die Anzahl der ESR-Linien durch die jeweils
2I+1-Einstellmöglichkeiten des betreffenden Kernspins gegeben ist. In unserem Institut
durchgeführte Electron-Spin-Echo-Envelope-Modulations-(ESEEM-)Messungen (Abb. 11) zeigen
eine starke Anisotropie der Hyperfeinkopplung des endohedralen Atoms mit den Elektronen
auf dem C82-Käfig. Dies ist ein deutliches Zeichen für eine dezentrale
Position des endohedralen Atoms, wie es auch in EXAFS-Röntgenuntersuchungen von einer
japanischen Gruppe gefunden wurde. Auch quantenchemische Berechnungen mit der
Dichtefunktionalmethode ergeben eine minimale Energie für eine Position außerhalb des
Zentrums [20].
4. Fulleride - Leitende und supraleitende Salze des C60
Wie bereits in den einleitenden Kapiteln dargelegt, läßt sich C60 sehr leicht
reduzieren, das heißt mit Elektronen beladen. Hierbei ist es möglich, bis zu sechs
Elektronen auf einem C60-Molekül unterzubringen (volle Besetzung des t1u-Orbitals).
Die durch Koevaporation von Alkalimetallen (K, Na, Rb, Cs) und C60
hergestellten Fulleride AxC60 (mit x = 1, 3, 4, 6) sind Salze mit
interessanten physikalischen Eigenschaften. Hierbei hängen die Kristallstrukturen noch
entscheidend vom Alkaliatom ab. Während K und Rb gleiche Kristallstrukturen, allerdings
bei verschiedenen Temperaturen, ausbilden, zeigen Na und Cs individuelle Unterschiede. Wir
werden diese im folgenden nicht weiter betrachten und uns auf die K- und Rb-Salze
beschränken.
Um die elektronischen Eigenschaften der Fulleride besser verstehen zu können,
vergegenwärtigen wir uns nochmals die Orbitale des C60 und betrachten dabei
gleichzeitig die Entstehung von Bandstrukturen durch intermolekularen Überlapp der C60-Orbitale
(Abb. 8). Für die Entstehung der Fulleride sind hierbei besonders die unbesetzten
Orbitale (t1u und t1g) interessant. Die hieraus entstehenden Valenz- und Leitungsbänder
bestimmen das elektronische Verhalten der Fulleride.
Bei maximaler Dotierung des t1u-Orbitals (mit sechs Elektronen) entsteht ein A6C60
(A = K, Rb) Salz mit kubischer Kristallstruktur, das die Eigenschaften eines Isolators
beziehungsweise Halbleiters mit großer Bandlücke besitzt. Hierzu gibt es bisher relativ
wenige Untersuchungen. A5C60 bildet keine stabile Phase und konnte
bisher jedenfalls nicht hergestellt werden. A4C60 dagegen existiert
sowohl für K, Rb als auch für Cs und besitzt eine tetragonale Kristallstruktur. Es zeigt
halbleitende Eigenschaften mit einer Energielücke von etwa 0,1 eV.
Besonders interessante Eigenschaften zeigen die A3C60 (A = K, Rb)
Verbindungen. Ihre Kristallstruktur ist kubisch flächenzentriert (Abb. 12), wobei die C60-Moleküle
sich auf den Ecken und Flächen eines Würfels befinden, während die Alkaliatome zwei
verschiedene Plätze einnehmen können, und zwar auf den Kanten und in der Mitte des
Würfels (Oktaeder-Plätze; O-Atome), wie auch auf sogenannte Tetraeder-Plätzen
(T-Atome), wo sie von vier C60-Molekülen, die sich an den Ecken eines
Tetraeders befinden, umgeben sind. In Abbildung 12 sind die O-Atome blau und die T-Atome
pink dargestellt. Außerdem erkennt man in Abbildung 12 noch eine grün dargestellte
Position. Hierbei handelt es sich ebenfalls um einen Tetraeder-Platz, wobei die grüne
Darstellung andeuten soll, daß hier ein T-Atom entfernt wurde (T-Leerstelle) und eine
entsprechende Anhäufung von negativer Ladungsdichte an dieser Stelle erfolgt. Dieser
Aspekt wird im folgenden noch ausführlicher diskutiert.
A3C60-Fulleride mit A = K, Rb zeigen metallisches Verhalten bei
Temperaturen oberhalb einer charakteristischen Temperatur Tc, unterhalb der sie
supraleitend werden. Diese sogenannte Sprungtemperatur Tc, die für K3C60
(Tc = 19,3 K) und Rb3C60 (Tc = 29,5 K)
unterschiedlich ist, ist erstaunlich hoch und erreicht bei Rb3C60
Temperaturen, die vor der Entdeckung der Hochtemperatur-Supraleiter noch als revolutionär
angesehen wurden. Allerdings ist man heute der Ansicht, daß die Supraleitung in den
Fulleriden nicht ungewöhnlich ist und im Rahmen der Bardeen, Cooper und
Schrieffer-(BCS-)Theorie verstanden werden kann. Nach dieser Theorie paaren sich die
Elektronen zu Cooperpaaren, bei denen jeweils zwei Elektronen mit entgegengesetztem Spin
(Gesamtspin S = 0, das heißt ¯) miteinander korreliert sind. Bei Eintritt des
supraleitenden Zustands sollte deshalb der Paramagnetismus der Leitungselektronen
verschwinden. Dies wird unter anderem in 13C- und 87Rb-NMR- (Nuclear
Magnetic Resonance) Messungen beobachtet [21]. Diese Messungen zeigen, daß unterhalb von
Tc die Verschiebungsdifferenz der 13C- und 87Rb-Linien
abnimmt. Das Verschwinden dieser sogenannten Knight-Verschiebung ist eine direkte Folge
der Cooperpaarbildung.
Es wurde ferner beobachtet, daß sich die Sprungtemperatur Tc durch geeignete
Wahl verschiedener Mischsysteme verändern läßt (Abb. 13) [22]. Die Ursache hierfür
liegt in der Änderung der Gitterkonstanten a in Abhängigkeit von den
Legierungsparametern. Gleichzeitig wird mit wachsender Gitterkonstante a der
intermolekulare orbitale Überlapp verringert, was zu einer Erhöhung der Zustandsdichte
NF an der Fermikante führt. Entsprechend der Beziehung
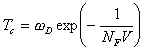
wobei der Parameter V ein Maß für die Kopplung der Leitungselektronen an Schwingungen
(Elektron-Phonon-Kopplung) ist, führt dies zu einer Erhöhung von Tc.
Außerdem ist eine große Debye-Frequenz wD, das heißt hohe
Schwingungsfrequenzen für das Erreichen großer Tc-Werte günstig. Bei den C60-Fullerenen
sind deshalb gerade die hochfrequenten intramolekularen Schwingungen für die Bindung der
Cooperpaare wichtig und führten so zu einer ungewöhnlich hohen Sprungtemperatur. Dies
kommt bei klassischen Supraleitern so nicht vor. Es ist eine besondere Eigenschaft dieser
molekularen Supraleiter.
Obwohl es den Anschein hat, daß viele physikalische Eigenschaften der A3C60-Fulleride
mit Standardmodellen erklärt werden können, gibt es Diskussionen darüber, ob
Elektron-Elektron-Korrelationen bei diesen Materialien eine Rolle spielen (halbgefülltes
Band). Nach diesen Vorstellungen müßte A3C60 eigentlich ein
Isolator und kein Leiter beziehungsweise Supraleiter sein [23]. Es sei denn, die
Stöchiometrie ist nicht exakt x = 3, sondern zum Beispiel x = 2,95. Dies würde bedeuten,
daß es Leerstellen von Alkaliatomen geben müßte. In der Tat wurde eine hohe
Konzentration an Leerstellen in dieser Substanzklasse sowohl in Röntgen- [24] als auch
NMR-Untersuchungen [25] gefunden. In einem zweidimensionalen NMR-Austauschexperiment
konnte gezeigt werden, daß ein thermisch aktivierter Austausch zwischen Alkaliatomen auf
Tetraeder-Plätzen stattfindet (Abb. 14) [25]. Die dabei beobachtete Konzentration der
Leerstellen entsteht bereits bei der Herstellung und ist in der Größenordnung, wie sie
für die Abweichung von der ganzzahligen Stöchiometrie (x = 3) gefordert wird, um einen
Metall-Isolator-Übergang zu verhindern.
Eine in den letzten Jahren besonders aktuell gewordene Klasse von Fulleriden sind die A1C60-Salze
mit
A = K, Rb, Cs. Oberhalb Zimmertemperatur besitzen diese Salze eine kubisch
flächenzentrierte (kfz) Struktur und sind metallisch. Dies ist bei der Beladung des C60-Moleküls
mit einem Elektron nicht sehr verwunderlich. Bei Abkühlung unter Zimmertemperatur
allerdings tritt ein Phasenübergang in eine orthorhombische Phase auf, die die
Eigenschaften eines niederdimensionalen Leiters besitzt. Dies ist beispielsweise aus der
Kristallstruktur (Abb. 15) plausibel, bei der die C60-Moleküle entlang der
orthorhombischen a-Achse einen so geringen Abstand haben, daß sie sich fast
"berühren". Der Elektronentransport wird deshalb vorwiegend entlang der a-Achse
angenommen. Es wurde außerdem spekuliert, daß es zu einer polymeren Verknüpfung der C60-Moleküle
entlang der kristallinen a-Achse kommen könnte [26]. Auf leitende und nichtleitende
polymere C60-Verbindungen wird im nächsten Abschnitt eingegangen.
5. Polymere und dimere C60-Verbindungen
Wie bereits im vorhergehenden Kapitel angedeutet, bestand die Vermutung, daß K1C60,
Rb1C60 und Cs1C60 eine polymere Phase
unterhalb Zimmertemperatur besitzen. Diese Vermutung beruhte auf dem geringen Abstand
entlang der a-Achse in diesen Verbindungen, was mit Hilfe von Röntgenuntersuchungen
festgestellt wurde [27]. Um dieser Frage nachzugehen, haben wir bereits frühzeitig
13C-NMR-Messungen unter Verwendung der "Magic Angle Spinning" (MAS-) Methode
durchgeführt. Hierbei konnten wir zeigen, daß in der Tat sp3-Kohlenstoffatome,
wie sie bei der Verknüpfung von C60-Molekülen auftreten sollten, beobachtet
werden [28, 29, 30]. Abbildung 16 verdeutlicht diesen Befund. Während die
Kohlenstoffatome des C60-Moleküls einen sogenannten sp2-Charakter
besitzen, was zu einer NMR-Linie im Bereich oberhalb 140 ppm führt, sollten
Kohlenstoffatome mit sp3-Charakter, wie sie typischerweise bei gesättigten
Kohlenstoffverbindungen auftreten, im Linienbereich 50-100 ppm ergeben. Eine mögliche
polymere Verbindung der C60-Moleküle über eine sogenannte 2+2 Zykloaddition,
wie in Abbildung 15 gezeigt, sollte also zum Auftreten von NMR-Linien in dem genannten
Bereich führen. Eine Analyse der temperarturabhängigen 13C-MAS-NMR-Linien (Abb. 16)
ergibt nun genau eine Bestätigung für eine derartige polymere Verknüpfung. Gleichzeitig
bestätigt die Analyse der Knight-Verschiebung und der Hyperfeinwechselwirkung das
Vorliegen eines polymeren Metalls [30].
Eine spezielle Klasse von nicht-leitenden C60-Polymeren kann sowohl durch
intensive Laserlichtbestrahlung von reinem C60 als auch durch Anwendung hohen
Drucks bei hohen Temperaturen erreicht werden. Auch hier geht es um den Nachweis, ob in
der Tat eine Polymerisierung stattgefunden hat. Röntgenuntersuchungen allein sind nicht
in der Lage, dies zweifelsfrei festzustellen. Mit Hilfe von 13C-MAS-NMR-Messungen lassen
sich, wie bereits beschrieben, eindeutig sp3-Kohlenstoffatome (Bindungen) von
sp2-Kohlenstoffatomen (C60-Molekül) unterscheiden. Wir konnten
deshalb mit dieser Methode nachweisen, daß bei bestimmten Drucken und Temperaturen ein
zweidimensional verknüpftes Polymer entsteht (Abb. 17) [31]. Während der Linienanteil
bei 140-150 ppm von den sp2-Kohlenstoffatomen des C60-Moleküls
außerhalb des Bindungbereichs kommt, liefern die sp3-Kohlenstoffe des
Bindungsbereichs eine deutlich ausgeprägte Linie bei 75 ppm. Aus der Stärke dieser Linie
im Vergleich mit den anderen Linien kann ein Anteil von 12/60 für die sp3-Linie
abgeschätzt werden, was dem erwarteten Verhältnis für die in Abbildung 17 dargestellte
zweidimensionale Polymerisierung unter 2+2-Zykloaddition entspricht.
6. Anwendungen
Verschiedene Anwendungen der Fullerene wurden bereits vorgeschlagen. Jedoch bedarf es
langer Entwicklungsphasen, bis ein Material in größerem Umfang zur routinemäßigen
Anwendung kommt. Dazu muß es deutlich bessere Eigenschaften als bekannte Materialien
besitzen, preiswerter herzustellen sein und nach Möglichkeit umweltverträglicher sein.
Besondere Eigenschaften der Fullerene wie die Photoleitfähigkeit [32], nicht-lineare
Absorption [33] und Elektrolunimeszenz [34] lassen Anwendungen im optischen Bereich zum
Beispiel bei optischen Begrenzern [35], als Toner für Photokopierer und Laserdrucker [36]
oder in der Elektrophotographie [37] erwarten.
Abbildung 18 zeigt zum Beispiel den Aufbau und Abbildung 19 die
Strom-Spannungscharakteristik sowie elektrisch detektierte ESR-Signale (EDESR) der
polaronischen Ladungsträger einer in unserem Institut hergestellten Photozelle auf der
Basis von Thiophen- und C60-Schichten [38]. Die Schichtdicken betragen etwa
0.15 µm. Die nichtlineare Diodencharakteristik ist in diesem mit einfachen Mitteln
hergestellten Bauteil zwar nur schwach ausgeprägt, verdeutlicht aber das Prinzip. Als
besondere wissenschaftliche Fragestellung konnte mit dieser Anordnung die
leitfähigkeitsdetektierte ESR der Polaronen-Ladungsträger in Thiophenoligomeren und C60-Fullerenen
nachgewiesen werden, wie in Abbildung 19 gezeigt ist [38]. Hierbei zeigt sich ein
deutlicher Unterschied dieser polaronischen Ladungsträger im Vergleich mit herkömmlichen
Elektronen und Löchern in Halbleitern. Die speziellen Eigenschaften dieser für
molekulare Systeme wichtigen Ladungsträger wird zur Zeit eingehend untersucht. Die sich
hieraus ergebenden Fragestellungen stehen unter anderem auch im Zusammenhang mit einer
molekularen Elektronik (Sonderforschungsbereich 329: Physikalische und chemische
Grundlagen der Molekularen Elektronik).
Neben diesen wenigen Beispielen gibt es eine Fülle von chemischen und biochemischen
Arbeiten zur Verwendung der spezifischen Eigenschaften der Fullerene in der Katalyse, bei
biochemischen Prozessen und als Vorstufe bei der Erzeugung von Diamant- und SiC-Schichten.
Fullerene als Ausgangsmaterial sind besonders rein und lassen sich leichter in die
gewünschten Modifikationen umwandeln als zum Beispiel Graphit. Es gibt sogar Behauptungen
einer russischen Forschergruppe, daß von ihnen Schichten aus Fullerenen hergestellt
wurden, die in der Lage sein sollen, Diamanten zu ritzen.
Auch die "Nanotubes" lassen interessante Anwendungen erwarten. Hierbei ist
einmal die extreme Festigkeit dieser Materialien von Bedeutung, aber auch ihre
Röhreneigenschaft, die es erlauben sollten, auf der Nanometerskala "Ampullen"
herzustellen, in die reaktive Substanzen eingefüllt werden könnten, um sie so geschützt
durch eine reaktive Umgebung transportieren zu können. Aber auch "molekulare
Drähte" für eine eventuelle molekulare Elektronik wären auf dieser Basis denkbar.
Voraussetzung hierfür ist natürlich die genaue Erforschung der strukturellen,
präparativen und elektronischen Eigenschaften dieser Materialien. Der Blick für
mögliche Anwendungen ist bereits bei den Forschern auf diesem Gebiet geschärft und man
darf gespannt sein, welche Anwendungen letztendlich von dieser neuen Materialklasse
ausgehen.
7. Zusammenfassung
Es wurde die neue Materialklasse der Fullerene vorgestellt. Ihre molekularen Eigenschaften
wie auch ihre elektronischen Zustände wurden beschrieben. Aus der Fülle der neuartigen
physikalischen Effekte wurden einige wenige, wie zum Beispiel die metallische Leitung und
Supraleitung, die Bildung von Polymeren und die optische Anregung, besonders betrachtet.
Perspektiven für einige Anwendungen wurden aufgezeigt.
8. Danksagung
Zu den in unserem Institut entstandenen Arbeiten haben insbesondere Dr. Marina Bennati,
Dr. Arthur Grupp, Dipl. Phys. Stefan Knorr, Dipl. Phys. Andreas Maier, Dipl. Phys.
Karl-Friedrich Thier und Dr. Gisela Zimmer beigetragen. Viele der Arbeiten entstanden in
Kooperation mit Dr. Férid Rachdi und Dr. Ch. Goze von der Universität in Montpellier.
Auf dem Gebiet der endohedralen Fullerene arbeiten wir mit den Kollegen Dr. Dunsch und Dr.
Bartl vom Institut für Werkstoffwissenschaften in Dresden zusammen. Die Deutsche
Forschungsgemeinschaft (DFG) hat einen Teil dieser Projekte finanziell unterstützt. Auch
dem Fond der Chemischen Industrie möchte ich für die finanzielle Unterstützung danken.
Literatur
[1] H. W. Kroto, J. R.Heath, S. C. O´Brien, R. F. Curl, and R. E. Smalley, Nature 318
(1985) 162
[2] W. Krätschmer, L. D. Lamb, K. Fostiropoulos, and D. R. Huffman, Nature 347 (1990) 354
[3] E. Osawa, Chem. Abstr. 74 (1971) 75698v
[4] D. A. Bochvar, E. G. Gal´pern, Dokl. Akad. Nauk SSSR 209 (1973) 610
[5] R. A. Davidson, Theor. Chim. Acta 58 (1981) 193
[6] R. F. Curl und R. E. Smalley, Science 242 (1988) 1017
[7] H. Kroto, Science 242 (1988) 1139
[8] R. E. Smalley, The Sciences, 31 (1991) 22
[9] in "Electronic Properties of High-Tc-Superconductors", eds. H. Kuzmany, M.
Mehring, J. Fink, Springer Series in Solid State Sciences 113 (1992)
[10] in "Electronic Properties of Fullerenes", eds. H. Kuzmany, M. Mehring, J.
Fink, S. Roth, Springer Series in Solid State Sciences 117 (1993)
[11] in "Progress in Fullerene Research" und folgende Jahrgänge, eds. H.
Kuzmany, M. Mehring, J. Fink, S. Roth, World Scientific 1994-1996
[12] S. Iijima, Nature 354 (1991) 56
[13] D. Ugarte, Nature 359 (1992) 707
[14] P. M. Ajayan und S. Iijima, Nature 361 (1993) 333
[15] T. W. Ebbesen, P. M. Ajayan, H. Hiura und K. Tanigaki, Nature 367 (1994) 519
[16] A. Lucas, Ph. Lambin und R. E. Smalley, J. Phys. Chem. Sol. 54 (1993) 587
[17] A. Lucas et al. in [11] (1994) 122
[18] (a) A. P. Ramirez, Superconductivity Review, Vol. 1 (1994); (b) R. C. Haddon, L. E.
Brus und K. Raghavachari, Chem. Phys. Lett. 125 (1986) 459; (c) S. C. Erwin und W. E.
Pickett, Science 254 (1991) 842
[19] M. Bennati, A. Grupp and M. Mehring, J. Chem. Phys. 102 (1995) 9457
[20] W. Andreoni und A. Curioni, in "Fullerenes and Fullerene Nanostructures, eds.
Kuzmany, J. Fink, M. Mehring, S. Roth, World Scientific, Singapore 1996, Seite 205
[21] G. Zimmer, Doktorarbeit Universität Stuttgart, 1995
[22] R. M. Fleming, A. D. Ramirez, M. J. Rosseinsky, D. W. Murphy, R. C. Haddon, S. M.
Zahurak und A. V. Makhija, Nature 352 (1992) 833
[23] R. W. Lof, M. A. van Veenendaal, B. Koopmans, H. T. Jonkman und G. A. Sawatzky, Phys.
Rev. Lett. 68 (1992) 3924
[24] J. E. Fischer, G. Bendele, R. Dinnebier, P. W. Stephens, C. L. Lin, N. Bykovetz und
Q. Zhu, J. Phys. Chem. Solids 56 (1995) 1445
[25] G. Zimmer, K. F. Thier, M. Mehring, F. Rachdi und J. E. Fischer, Phys. Rev. B 53
(1996) 5620
[26] O. Chauvet, G. Oszlanyi, L. Forro,
P. W. Stephens, M. Tegze, G. Faigel und A. Janossy, Phys. Rev. Lett. 72 (1994) 2721
[27] P. W. Stephens, G. Bortel, M. Tegze, A. Janossy, S. Pekker, G. Oszlanyi und L. Forro,
Nature 370 (1994) 636
[28] T. Kälber, G. Zimmer und M. Mehring, Z. Phys. B 27 (1995) 2
[29] T. Kälber, G. Zimmer und M. Mehring, Phys. Rev. B 51 (1995) 16471
[30] K. F. Thier, G. Zimmer, M. Mehring and F. Rachdi, Phys. Rev. B 53 (1996) R496
[31] C. Goze, F. Rachdi, L. Hajji, M. Núnez-Regueiro, L. Marques, J.-L. Hodeau und M.
Mehring, Phys. Rev. B 54 (1996) R3676
[32] (a) J. Mort et al. Chem. Phys. Lett. 186 (1991) 281; (b) K. Pichler et al., J. Phys.:
Cond. Matter 3 (1991) 9259
[33] W. Tutt und A. Kost, Nature, 356 (1992) 225
[34] (a) M. Uchida et al. Jap. J. Appl. Phys. II 30 (1991) L2104; (b) A.T. Werner et al.
Appl. Phys. A 57 (1993) 157
[35] US Patent 5172278
[36] US Patent 5188918
[37] US Patent 5215841
[38] A. Maier, A. Grupp und M. Mehring, Sol State Commun. 99 (1996) 623
Der Autor
Professor Dr. Michael Mehring, geboren am 7. Oktober 1937, hat Physik an der Universität
Münster studiert. Dort promovierte er 1968 zum Dr. rer. nat. über die Entwicklung eines
Spin-Echo-Verfahrens für die Untersuchung von quadrupolgestörten Festkörpern. Von 1969
bis 1971 war er Research Associate am MIT in Cambridge/USA, anschließend Privatdozent an
der Universität Münster und von 1972 bis 1981 wissenschaftlicher Rat und Professor der
Abteilung Physik an der Universität Dortmund. Seit Dezember 1981 leitet Prof. Mehring das
2. Physikalische Institut der Universität Stuttgart. Im Rahmen verschiedener
Forschungsaufenthalte war er Gastprofessor an der University of California in Berkeley.
Außerdem ist Michael Mehring Mitglied nationaler und internationaler Fachgremien und
Organisator von internationalen Tagungen. Die Arbeitsgebiete des Autors sind:
Hochtemperatur-Supraleiter, organische Leiter, molekulare Elektronik, Kernspinpolarisation
und Spindynamik, Kernspinresonanz (NMR/NQR), Elektronenspinresonanz (ESR).
|